LA PHYSIQUE
![]()
![]() Définition
Définition
Le plongeur subit une augmentation importante de pression lorsqu'il s'immerge.
La pression est une force sur une surface

P = pression, exprimée en Kg force/cm2
F = force, exprimée en Kg force
S = surface, exprimée en cm2
|
L'unité légale est le bar : |
1 bar = 1 Kg force/cm2. |
On note que la pression est d'autant plus forte :
- si la force exercée est grande,
- si la surface sur laquelle s'exerce cette force est petite.
Exemple :
Prenons une force égale à 1 tonne force sur une surface de 1 dm2, quelle est la pression exercée ?
1 000 Kg force, divisé par 100 cm2 = 10 bar de pression
![]() La
pression Atmosphérique
La
pression Atmosphérique
Au niveau de la mer on subit la pression atmosphérique qui est de 1 bar (poids de la colonne d'air s'exerçant sur 1 cm2 de surface). Elle diminue avec l'altitude. Un litre d'air pèse 1,293 gramme.
![]() La
pression Hydrostatique ou pression relative
La
pression Hydrostatique ou pression relative
En immersion, le poids de l'eau vient s'ajouter : c'est la pression hydrostatique (poids de la colonne d'eau s'exerçant sur 1 cm2 de surface).
Une colonne d'eau de 10 mètres de haut sur 1 cm2 de surface, représente 1 bar.

Exemple :
P. Relative à 30 m ![]() 30 / 10 = 3
30 / 10 = 3
P. Relative à 47 m ![]() 47 / 10 = 4.7
47 / 10 = 4.7
Inversement :
|
P. Relative = 4 |
profondeur ? |
4 X 10 = 40 mètres |
|
P. Relative = 5.2 |
profondeur ? |
5,2 X 10 = 52 mètres |
![]() Pression
absolue
Pression
absolue
la pression totale que le plongeur reçoit en immersion est la somme des deux pressions ci-dessus.
P. Abs = P. Atm + P. Relative
Exemple :
P. Abs à 40m = 1 + (40/10) = 5
Inversement :
|
P. Abs = 3 bar |
Profondeur ? |
(3-1) x 10 = 20 mètres |
![]() En
plongée
En
plongée
- si l'on descend, la pression augmente
- si l'on remonte, la pression diminue
![]()
![]() Mise
en évidence
Mise
en évidence

Le volume d'un gaz est inversement proportionnel à la pression qu'il subit :
|
P X V = Constante |
Ou |
P1 X V1 = P2 X V2 |
Formule : P1 x V1 = P2 x V2
Le volume d'un ballon en surface = 12 litres
Quelle sera son volume à 10 mètres ?
1 x 12 = 2 x V2
V2 = (1 x 12) / 2 = 6 litres
![]() Applications
et conséquences en plongée
Applications
et conséquences en plongée
![]() Application
Application
- chargement des bouteilles de plongée,
- amélioration de la flottabilité,
- profondimètres mécaniques,
- levage, bouées...
![]() Conséquences
Conséquences
- barotraumatismes,
- accident de décompression,
- consommation en air variable selon la pression.
![]()
(La notion de flottabilité)
exemple :
le poids d'un bloc en dehors de l'eau est le poids réel. Dans l'eau, le bloc est moins lourd, c'est le poids apparent.
![]() mise en évidence
mise en évidence
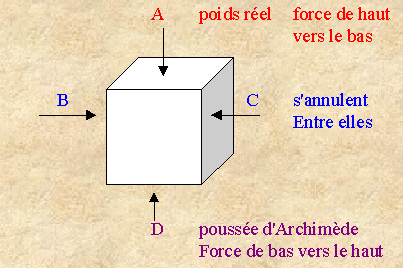
![]() Loi
Loi
Tout corps plongé dans un liquide reçoit, de la part de ce liquide, une poussée verticale, dirigée de bas en haut, égale au poids du liquide déplacé.
![]() Le
poids apparent
Le
poids apparent
Poids apparent = Poids Réel - Poussée d'Archimède
Prenons un corps est comparons :
- si P. app > 0 ![]() flottabilité
négative
flottabilité
négative ![]() il coule
il coule
- si P. app = 0 ![]() flottabilité nulle
flottabilité nulle
![]() équilibre
équilibre
- si P. app < 0 ![]() flottabilité
positive
flottabilité
positive ![]() il remonte
il remonte
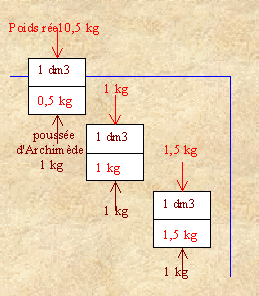
|
Poids apparent |
Flottabilité |
conséquence |
|
|
1) P app = 0,5 - 1 = -0,5 kg |
< 0 |
Positif |
Remonte |
|
2) P app = 1 - 1 = 0 kg |
= 0 |
Nulle |
équilibre |
|
3) P app = 1,5 - 1 = 0,5 kg |
> 0 |
Négatif |
coule |
Exemple :
1 ) Quel est le poids apparent d'une ancre pesant 32 kg pour un volume de 15 dm3
32 - 15 = 17 kg, donc elle coule
2) un boîtier de caméra pèse 4 kg et a un volume de 5 dm3. Quel poids doit-on ajouter à l'intérieur pour l'équilibrer dans l'eau.
Poids apparent = 4 - 5 = - 1 kg. On doit ajouter 1 kg pour avoir un poids apparent nul.
![]() Application
à la plongée
Application
à la plongée
- poumon ballast,
- calculs de lestages et de levages,
- utilisation du gilet de stabilisation.
![]() Conséquences
Conséquences
- la flottabilité diminue si la profondeur augmente (diminution du volume de la combinaison),
- la flottabilité augmente en cours de plongée, par la consommation de l'air contenu dans la bouteille,
- avec la loi de Mariotte (l'air contenu dans le gilet de stabilisation), le volume d'air augmente à la remontée, donc la poussée d'Archimède sera plus forte. Risque de remonter rapidement.
![]()
Le plongeur respire de l'air comprimé. L'air est composé de plusieurs gaz qui, à partir d'une certaine pression peuvent devenir toxiques. Il faut savoir calculer la pression partielle de chacun de ces gaz.
![]() Composition
de l'air
Composition
de l'air
|
Oxygène (O2) |
|
20,9 % |
|
Azote (N2) |
|
79 % |
|
Dioxyde de carbone (Co2) |
|
0,03 % |
|
Gaze rares : néon, crypton, argon... |
|
0,07 % |
![]() Mise
en évidence
Mise
en évidence

![]() Loi
et formule
Loi
et formule
![]() la pression
partielle d'un gaz dans un mélange est la pression qu'aurait
ce gaz s'il occupait seul tout le volume du mélange.
la pression
partielle d'un gaz dans un mélange est la pression qu'aurait
ce gaz s'il occupait seul tout le volume du mélange.
![]() Dans un
mélange gazeux, la somme des pressions partielles des
composants de ce mélange est égale à
la pression du mélange.
Dans un
mélange gazeux, la somme des pressions partielles des
composants de ce mélange est égale à
la pression du mélange.
![]() La pression
partielle d'un gaz dans un mélange est obtenue par la
formule suivante :
La pression
partielle d'un gaz dans un mélange est obtenue par la
formule suivante :
Pp = (P absolue) X (% du gaz)
Exemple :
Quelle est la pression partielle de l'azote
respiré en surface ? ![]() Pp N2 = 1 X 80/100 = 0,8 bar
Pp N2 = 1 X 80/100 = 0,8 bar
Pour l'oxygène ![]() Pp O2 = 1 x 20/100 = 0.2 bar
Pp O2 = 1 x 20/100 = 0.2 bar
![]() Application
à la plongée :
Application
à la plongée :
- utilisation de mélanges différents de l'air (nitrox, trimix)
- calcul des tables de plongée
![]() Conséquences :
Conséquences :
- toxicité des gaz : accidents bio-chimiques
- mécanisme de l'accident de décompression
![]()
(dissolution des gaz)
Les liquides dissolvent des gaz, exemple : ouverture d'une bouteille de boisson gazeuse.
Le plongeur va dissoudre plus d'azote qu'à la surface.
Conséquence : problème à la remontée, idem pour la bouteille de boisson gazeuse.
![]() Mise
en évidence
Mise
en évidence
|
état de saturation : état d'équilibre (si Pp = T)
|
|
Q = Quantité de gaz dissout T = tension : |
|
état de sous-saturation : le liquide absorbe le gaz en le dissolvant (si Pp > T)
|
|
La quantité augmente progressivement jusqu'à 2 Q |
|
état de sous-saturation : le liquide absorbe le gaz en le dissolvant (si Pp > T) |
|
La quantité augmente progressivement jusqu'à 3 Q |
|
état de saturation : état d'équilibre (si Pp = T)
|
|
Equilibre parfait entre la pression partielle et la tension |
|
état de sur-saturation : le liquide restitue le gaz dissout. (si Pp < T)
|
|
La quantité de gaz dissout diminue progressivement jusqu'à la Pp de 1 bar et crée des micros bulles dans le liquide |
On parle de tension d'un gaz lorsqu'on est en phase dissoute dans un liquide, et de pression partielle d'un gaz dans un mélange lorsqu'on est en phase gazeuse.
En plongée on respire de l'air à la pression ambiante, l'organisme va se charger en N2 sous l'effet de la pression. Pour éviter la sur-saturation rapide (avec bulles), le plongeur doit remonter lentement (15m/mn) et faire ses paliers si nécessaire. Sinon il a de grande chance de faire un accident de décompression.
![]() Les
facteurs de dissolution pour un plongeur
Les
facteurs de dissolution pour un plongeur
- la profondeur : si elle augmente, Q augmente,
- la profondeur : si elle diminue, Q diminue,
- la durée : si elle augmente, Q augmente,
- l'effort physique : s'il augmente, Q augmente,
- la température : si elle augmente, Q augmente.
![]() La
Loi
La
Loi
A température donnée et à saturation, la quantité de gaz dissoute dans un liquide est proportionnelle à la pression du gaz au dessus du liquide.
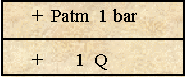 T
T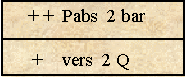 T
T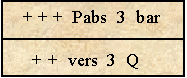 T
T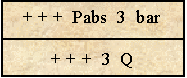 T
T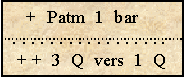 T
T
